Molekularny kurier wzroku. Sekrety RBP3 ujawnione
Czas czytania: około 8 minut
Naukowcy po raz pierwszy zajrzeli w głąb struktury białka, które może decydować o naszym widzeniu - i odkryli, że jest ono znacznie bardziej dynamiczne, niż przypuszczano. RBP3 nie tylko zmienia swój kształt w zależności od ładunku, ale może również odgrywać rolę w ochronie siatkówki przed chorobami - od retinopatii cukrzycowej po barwnikowe zwyrodnienie siatkówki.
Śródmiąższowe białko wiążące retinol 3 (RBP3) to glikoproteina o masie około 140 kDa, występująca w przestrzeni międzykomórkowej siatkówki. Odgrywa ona istotną rolę w transporcie retinoidów - cząsteczek niezbędnych do prawidłowego przebiegu procesu widzenia. Choć o istnieniu RBP3 wiadomo od lat, jego struktura i dokładne mechanizmy działania pozostawały dotąd nieznane. Brak tych informacji stanowił istotną lukę w badaniach nad chorobami oczu, zwłaszcza tymi prowadzącymi do nieodwracalnej utraty wzroku.
Zwyrodnienie barwnikowe siatkówki (retinitis pigmentosa, RP) to jedna z takich chorób - podstępna, postępująca i wciąż nieuleczalna. Dotyka miliony ludzi na całym świecie, prowadząc do stopniowego zaniku fotoreceptorów i ślepoty. Dotychczasowe badania sugerowały, że nieprawidłowości w funkcjonowaniu RBP3 mogą być jednym z czynników przyczyniających się do rozwoju tej choroby, jednak brakowało szczegółowej wiedzy na temat jego struktury i mechanizmu działania. Nowe odkrycia rzucają światło na tę zagadkę, otwierając drogę do potencjalnych terapii, które mogłyby spowolnić lub nawet zatrzymać degenerację siatkówki.
Międzynarodowy zespół naukowców, w tym badacze z ICTER, wykorzystał nowoczesne metody analizy strukturalnej, aby po raz pierwszy uzyskać obraz natywnej struktury RBP3 z bardzo wysoką dokładnością. Wyniki opublikowano w czasopiśmie Open Biology w pracy zatytułowanej "CryoEM structure and small-angle X-ray scattering analyses of porcine retinol- binding protein 3".
- Po raz pierwszy udało nam się uchwycić pełną strukturę natywnego RBP3 u świń z rozdzielczością 3,67 Å. To istotny krok w zrozumieniu funkcji tego białka, zwłaszcza w kontekście jego roli w transporcie retinoidów i kwasów tłuszczowych w oku - mówi dr Humberto Fernandes z ICTER.
Dlaczego RBP3 jest takie ważne?
Widzenie jest procesem, który zaczyna się od przekształcenia światła w sygnał elektryczny przez fotoreceptory w siatkówce oka. Kluczowym elementem tej przemiany jest cykl wzrokowy - skomplikowany łańcuch reakcji chemicznych, w którym niezbędną rolę odgrywają retinoidy, czyli pochodne witaminy A. Jednak aby mogły one skutecznie pełnić swoją funkcję, muszą być transportowane pomiędzy różnymi komórkami siatkówki. Za ten transport odpowiada właśnie śródmiąższowe białko wiążące retinol 3 (RBP3), które funkcjonuje jak "kurier" dostarczający retinoidy tam, gdzie są potrzebne.
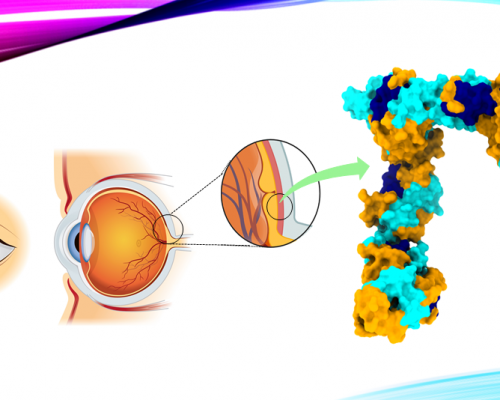
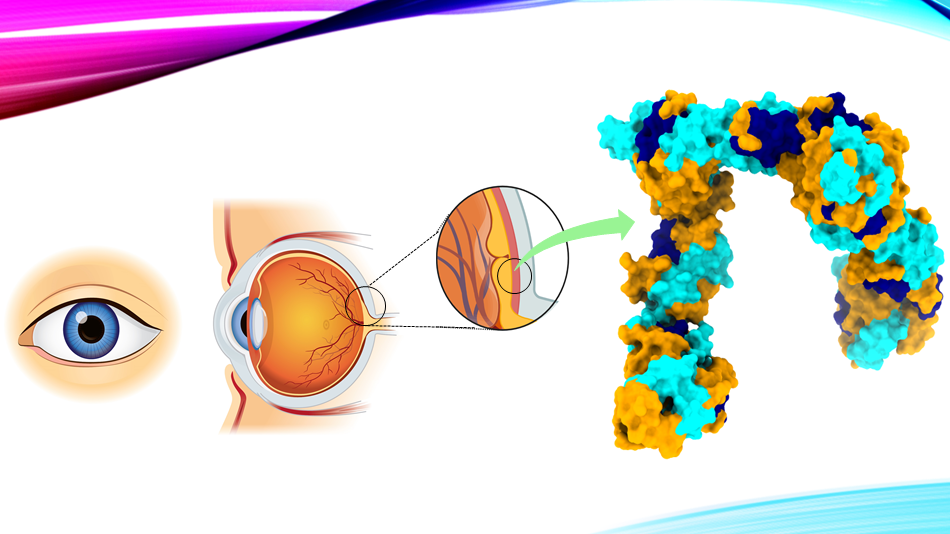
RBP3 występuje w interfotoreceptorowej macierzy pozakomórkowej (IPM), czyli przestrzeni pomiędzy nabłonkiem barwnikowym siatkówki a fotoreceptorami. To tam zachodzi transport cząsteczek niezbędnych do prawidłowego funkcjonowania oka, w tym tlenu, składników odżywczych oraz właśnie retinoidów. RBP3 odgrywa kluczową rolę w dostarczaniu all-trans-retinolu (at-ROL) z fotoreceptorów do nabłonka barwnikowego siatkówki, gdzie zostaje on przekształcony w 11-cis-retinal (11c-RAL) - cząsteczkę kluczową dla widzenia. Następnie 11c-RAL wraca do fotoreceptorów, gdzie wiąże się z opsynami, tworząc światłoczułe pigmenty, które umożliwiają widzenie. Bez białka RBP3 ten cykl transportowy byłby znacznie mniej efektywny, co mogłoby prowadzić do niedoborów retinoidów w fotoreceptorach, a w konsekwencji do degeneracji siatkówki.
Pod względem budowy, RBP3 jest dużą glikoproteiną składającą się z czterech modułów wiążących retinoidy. Każdy z tych modułów ma charakterystyczną strukturę umożliwiającą interakcję z różnymi cząsteczkami, w tym retinoidami i kwasami tłuszczowymi, takimi jak kwas dokozaheksaenowy (DHA). Dotychczas nie było jednak jasne, jak dokładnie białko to oddziałuje ze swoimi ligandami oraz czy jego struktura ulega zmianom w zależności od rodzaju transportowanej cząsteczki.
Wiadomo natomiast, że RBP3 pełni dodatkowe funkcje ochronne. Chroni retinoidy przed degradacją pod wpływem światła, ograniczając ich utlenianie i rozpad. Jego obecność w IPM stabilizuje środowisko biochemiczne siatkówki, co ma kluczowe znaczenie dla zdrowia oczu. Co więcej, mutacje w genie kodującym RBP3 są związane z szeregiem chorób oczu, takich jak zwyrodnienie barwnikowe siatkówki (RP) oraz z niektórymi formami krótkowzroczności.
Jak przeprowadzono badania?
Aby uchwycić trójwymiarową strukturę RBP3, badacze wykorzystali kriomikroskopię elektronową (cryoEM), czyli technikę pozwalającą na uzyskanie obrazów biomolekuł w niemal natywnym stanie, w temperaturze kriogenicznej. W badaniach zastosowano również analizę rozpraszania promieniowania rentgenowskiego pod małymi kątami (SAXS), dzięki której możliwe było określenie konformacyjnych zmian białka w roztworze.
Pierwszym krokiem było pozyskanie białka w formie natywnej. W tym celu badacze wyizolowali RBP3 z siatkówek świńskich gałek ocznych pozyskanych z lokalnych rzeźni. Tkanki były przechowywane w warunkach minimalizujących degradację białek - na lodzie, w ciemności.. Następnie oczyszczono RBP3 za pomocą zaawansowanych technik chromatograficznych, w tym chromatografii powinowactwa, chromatografii jonowymiennej oraz filtracji żelowej. Każdy etap tej procedury miał na celu uzyskanie stabilnej i funkcjonalnej postaci białka, co było kluczowe dla dalszych badań.
Po uzyskaniu czystych próbek białka, naukowcy rozpoczęli eksperymenty z użyciem kriomikroskopii elektronowej. Próbki RBP3 zostały schłodzone do ekstremalnie niskich temperatur i umieszczone w wiązce elektronów, co pozwoliło na uzyskanie setek tysięcy obrazów pojedynczych cząsteczek. Złożenie tych obrazów w trójwymiarowy model umożliwiło odtworzenie struktury białka w niespotykanej dotąd rozdzielczości 3,67 Å.
Równolegle zastosowano analizę SAXS, która dostarczyła dodatkowych informacji o konformacyjnej plastyczności RBP3 w roztworze. Eksperymenty te pozwoliły na obserwację, jak białko zmienia swój kształt po związaniu różnych cząsteczek, w tym retinoidów i kwasów tłuszczowych. Dzięki temu badacze odkryli, że RBP3 przyjmuje różne konformacje w zależności od rodzaju transportowanego ładunku, co może być kluczowe dla jego funkcji jako dynamicznego nośnika retinoidów.
- To jedno z najdokładniejszych badań strukturalnych RBP3, jakie kiedykolwiek przeprowadzono. Dzięki połączeniu metod cryoEM i SAXS uzyskaliśmy wyjątkowy wgląd w sposób działania tego białka - wyjaśnia dr Humberto Fernandes z ICTER.
Co udało się ustalić?
Jednym z kluczowych odkryć tego badania jest zdolność RBP3 do zmiany kształtu w zależności od rodzaju wiązanej cząsteczki. W eksperymentach wykazano, że po związaniu 11-cis-retinalu (11c-RAL) oraz all-trans-retinolu (at-ROL) białko przybiera różne konformacje - od zwartej do otwartej. Analizy SAXS wykazały, że przy wyższych stężeniach tych retinoidów RBP3 ulega wydłużeniu, co może sugerować mechanizm jego działania jako dynamicznego transportera retinoidów.
- To odkrycie jest szczególnie interesujące, ponieważ sugeruje, że RBP3 może działać jako elastyczny nośnik retinoidów, zmieniający kształt w celu optymalizacji transportu tych cząsteczek między nabłonkiem barwnikowym siatkówki a fotoreceptorami - mówi dr Vineeta Kaushik z ICTER.
Dodatkowe informacje na temat plastyczności białka dostarczyły analizy dokowania molekularnego, które wskazały na obecność dwóch głównych miejsc wiązania ligandów. Co ciekawe, analiza SAXS wykazała, że wiązanie kwasów tłuszczowych, takich jak DHA (dokozaheksaenowy), nie prowadziło do znaczących zmian w strukturze RBP3, co oznacza, że jego rola w transporcie tych cząsteczek może różnić się od transportu retinoidów.
To przełomowe odkrycie zmienia nasze rozumienie roli RBP3 w oku. Zamiast traktować je jako bierny transporter retinoidów, zaczynamy dostrzegać w nim aktywny, adaptujący się mechanizm, który może precyzyjnie regulować dostarczanie kluczowych cząsteczek do fotoreceptorów. Zrozumienie tej dynamiki otwiera nowe możliwości dla badań nad cyklem wzrokowym i potencjalnych terapii chorób degeneracyjnych siatkówki.
Co dalej?
Odkrycie pełnej struktury RBP3 i jego konformacyjnej plastyczności otwiera nowy rozdział w badaniach nad funkcjonowaniem cyklu wzrokowego oraz mechanizmami prowadzącymi do degeneracji siatkówki. Wyniki mogą mieć kluczowe znaczenie dla diagnostyki i terapii chorób oczu, w tym retinopatii cukrzycowej, barwnikowego zwyrodnienia siatkówki oraz wysokiej krótkowzroczności.
Wcześniejsze badania sugerowały, że obniżony poziom RBP3 w siatkówce jest powiązany z progresją retinopatii cukrzycowej, a jego stabilizacja mogłaby działać ochronnie. Teraz, dzięki precyzyjnym danym strukturalnym, naukowcy mogą skupić się na opracowaniu nowych strategii terapeutycznych, które modulowałyby aktywność RBP3 i mogłyby spowolnić postęp tej choroby. Możliwe jest również wykorzystanie RBP3 jako biomarkera diagnostycznego, co mogłoby pomóc w identyfikacji pacjentów zagrożonych utratą wzroku na wczesnym etapie choroby. Zespół planuje dalsze badania nad dynamiką funkcji RBP3 zarówno w warunkach fizjologicznych, jak i patologicznych.
- To dopiero początek. Teraz, gdy mamy trójwymiarowy model RBP3, możemy badać, jak dokładnie oddziałuje on z innymi białkami siatkówki i jak możemy wykorzystać te informacje do opracowania nowych metod leczenia - podsumowuje dr Humberto Fernandes.
Autorzy pracy "CryoEM structure and small-angle X-ray scattering analyses of porcine retinol-binding protein 3": Vineeta Kaushik, Luca Gessa, Nelam Kumar, Matyáš Pinkas, Mariusz Czarnocki-Cieciura, Krzysztof Palczewski, Jiří Nováček i Humberto Fernandes.
Autor: red. naukowy Marcin Powęska
- Autor: Marcin Powęska
- Materiał graficzny: Nelam Kumar
- Data wpisu: 2.04.2025